
近期,由省外迁入广东省注册的4个注册证获批上市,成为首批按照《关于已上市第二类医疗器械迁入我省注册申报指引(试行)》获批的产品,省药品监管局重点综合改革项目“优化第二类医疗器械注册审评审批”中省外已上市产品迁入我省注册办理新模式顺利落地实施。
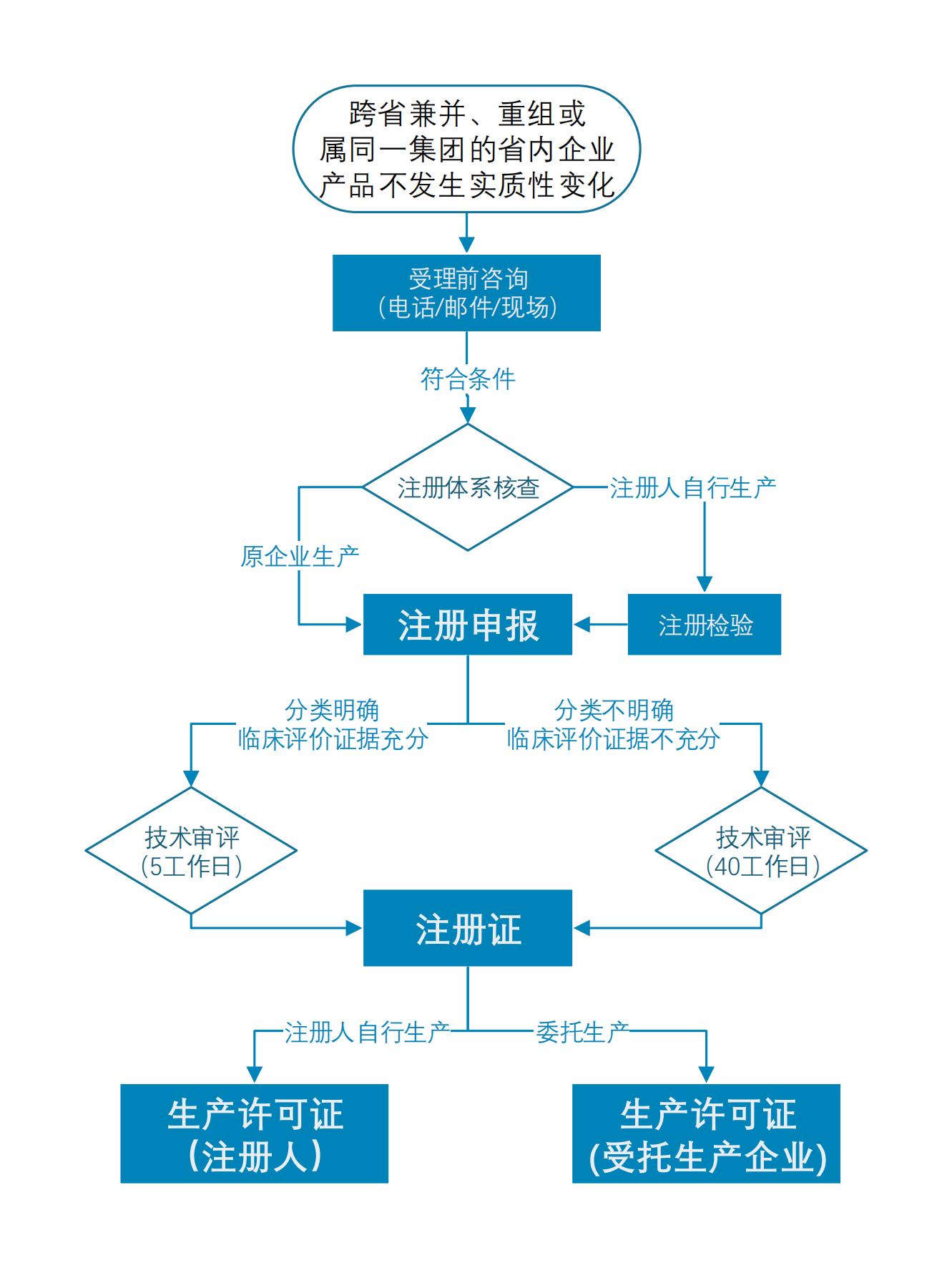
依据《医疗器械监督管理条例》,第二类医疗器械由省级药品监管部门审批,企业跨省迁移一般按新产品在迁入地申请首次注册,办理周期较长。省药品监管局瞄准行业痛点,大力开展综合改革,在为企业减负、优化流程上下功夫,“三个明确”探索准入新模式。
一是明确主体责任。
跨省兼并、重组或属同一集团的省内企业,可将已获省外第二类医疗器械注册证产品迁入我省注册,企业需开展前后产品差异评价,确保产品不发生实质性变化。
二是明确程序标准。
按照标准不降低、程序不减少的原则,依据最新法规、文件要求开展申报资料、技术审评、注册核查、生产许可审查,重点评估与产品质量相关的风险,确保产品质量安全。
三是明确提速增效。
通过事前充分沟通交流、无纸化提交申报资料、提前开展注册核查、优化技术审评流程等方式,仅用5个工作日完成技术审评,比法定时间提速90%以上。
随着我省医疗器械注册工作进一步优化和完善,审评审批效率显著提升,跨省迁入新模式也得到了业界的积极响应。目前已有30家企业的60多个产品正在对接迁移准备工作,有10多个产品即将进入注册申报阶段。接下来,省药品监管局将继续畅通沟通交流渠道,强化事前指导服务,积极探索境外企业通过其独资、合资或者授权的我省企业,将进口医疗器械落户我省生产的办理模式。
关键信息解读——
已上市第二类医疗器械迁入我省注册申报指引如下
1.申报资料
医疗器械/ 体外诊断试剂产品的综述资料、非临床资料(不含注册检验报告)、临床评价资料,可提交已获证医疗器械/体外诊断试剂的原注册申报资料。
对拟迁入注册的产品,继续在原生产企业生产的,且生产条件(包括生产地址、生产要素 等)不发生变化的,注册检验报告可提交原获证时提交的报告。
2.技术审评
对产品分类明确、临床评价证据充分的,技术审评时可仅对产品检验报告采纳强制性标准的完整性、试剂类产品适用的国家标准品检测情况进行审查,技术审评时限不超过5个工作日。
对产品分类不明确或临床评价证据不充分的,应按照正常程序开展技术审评。
3.注册核查
注册申请人应当确保生产包含产品的主要生产工艺,并承诺主要原材料和生产工艺不发生改 变,提供产品生产质量管理体系符合《医疗器械生产质量管理规范》及附录的自查报告。
4.生产许可
注册人自行生产的,应按照《医疗器械生产监督管理办法》要求向省局申请办理医疗器械生产许可。注册人委托生产的,受托生产企业按照《医疗器械生产监督管理办法》有关要求向其所在地省级药品监管部门申请办理医疗器械生产许可有关手续。

中检华通威注册服务指引
转载注明:https://www.szhtw.com.cn/








